Aku töötab lihtsa keemilise reaktsiooni põhimõttel, mis toimub tavaliselt kolme elemendi vahel. Nende ainete vaheline reaktsioon tekitab elektrivoolu. See ongi selle põhiolemus.
Kolm peamist objekti:
- Anood "+"
- Katood "-"
- Elektrolüüt
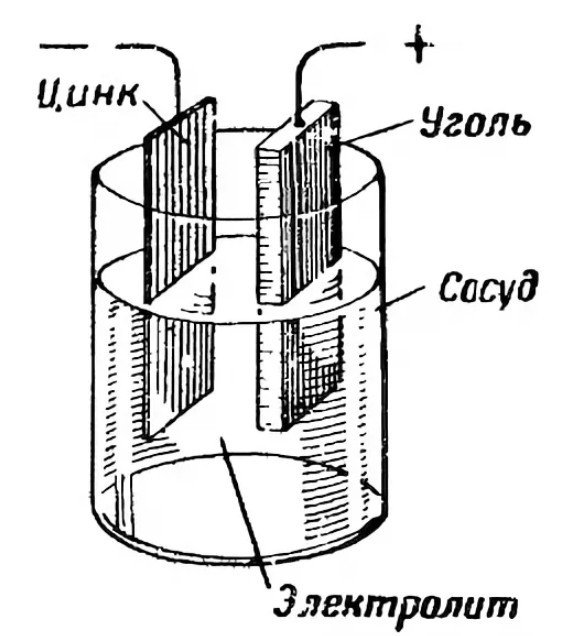
Anood ehk positiivne poolus toimib elektronide allikana. See on tavaliselt valmistatud tsingist. Kaks elektroodi interakteeruvad üksteisega elektrolüüdi kaudu. Elektrolüüt on tavaliselt sool, ammooniumkloriid või leelis. See võib olla kuiv või vedel. Aine paksendamiseks lisavad tootjad polümeerühendeid. Mõned kasutavad tärklist.
Kuidas aku töötab
Vool liigub positiivsest poolusest negatiivsesse. See juhtub siis, kui akuga on ühendatud koormus. Juba positiivse ja negatiivse klemmi ühendamine juhtmega põhjustab lühise. See võib aku kiiresti tühjendada ja isegi tulekahju põhjustada.
Katood toimib redutseerijana, omandades anoodilt elektrone. Elektrolüüdi keskkonnas liiguvad ioonid vabalt ja hõlbustavad efektiivset voolu genereerimist.
Mis keemiliselt toimub?
Näiteks klaasis mahutavusValame väävelhappelahusesse tsinkpulga. Pulga pinnal on positiivselt laetud ioonid. Aine negatiivsed ioonid kogunevad lahuses tsinkobjekti ümber. Lahus avaldab ligitõmbavat jõudu, mis eraldab tsingiioone kergesti. Selle tulemusena omandab vedelik positiivse laengu ja tsinkplaat või -pulk negatiivse laengu. Füüsika ütleb meile, et potentsiaalide vahe võrdub pingega. See tekitab elektrivoolu.
Selle tulemusel tekib happelahuse ja metalli kokkupuutel liidesel elektriväli. Sel hetkel muundatakse keemiline energia elektrienergiaks. Nii töötab aku.
Mõne aja pärast aku tööiga saab otsa. Kõik sõltub sellest, kus ja kuidas toiteallikat kasutatakse. Näiteks kui see annab energiat taskulambile, siis mõõduka kasutamise korral kestavad kaks 1,5-voldist akut kumbki kuu aega. Kui aga panna need samad akud elektriautosse, töötab see vaid paar tundi.
Kõige selle tulemusel võime järeldada, et mida suurem on koormus, seda kiiremini aku tühjeneb.
Loe ka: